
Du skal bruge idealgasligningen:n = pV/(RT). Huskede du at omregne fra celsius til Kelvin? Korrekt svar er 241 K. Du får dannet 2 mol vand på gasform. Volumenet er proportional med stofmængden jævnfør idealgasligning: pV = nRT. Derfor bliver de 3 liter gas til 2 liter vand i overensstemmelse med koefficienterne i reaktionsskemaet. Svaret er 24,8 L/mol. Du skal have fat i idealgasligningen V = nRT/p, hvor du indsætter n = 1 mol, T = 298 K og p = 100.000 Pa.
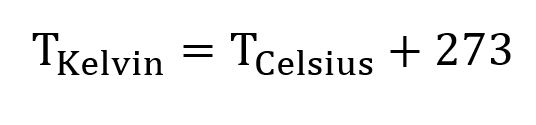
#1. Omregn temperaturen 100 grader celsius til den tilsvarende temperatur i Kelvin. Afrund til nærmeste heltal.
#2. Hvad er trykket cirka ved jordens overflade?
#3. En gas opvebares ved et tryk på 200.000 Pa ved stuetemperatur (25 grader celsius). Volumenet af gasflasken er 0,1 m3. Hvad er stofmængden af gaspartikler i flasken? Angiv dit svar i mol og afrund til nærmeste heltal.
#4. En gas opvebares ved et tryk på 200.000 Pa i en beholder med at volumen på 0,1 m3. Der er 10 mol gas i beholderen. Hvad er temperaturen af gassen? Angiv dit svar i K og afrund til nærmeste heltal.

#5. Betragt forbrændingen af dihydrogen. Du har sammenlagt 3 mol gaspartikler inden forbrændingen finder sted, henholdsvis 2 mol H2 og 1 mol O2. Hvor mange mol gas har du, når reaktionen er løbet til ende?

#6. Betragt forbrændingen af dihydrogen. Du har sammenlagt 3 liter gaspartikler inden forbrændingen finder sted, henholdsvis 2 liter H2 og 1 liter O2. Hvor mange liter gas har du, når reaktionen er løbet til ende?
#7. Hvad er volumenet af 1 mol gas ved atmosfærisk tryk og temperatur (p = 100.000 Pa og T = 298K)? Angiv dit svar i liter med første decimal.

