
Select all that apply: Svaret er 0,3. Saltsyre (HCl) er en stærk syre som afgiver ALLE H<sup> </sup>-ioner til vand. Vi kan derfor antage at den aktuelle stofmængdekoncentration af H<sup> </sup> er den samme som den formelle koncentration af HCl, altså [H<sup> </sup>] = 0.5 mol/L. Derefter beregner vi blot pH som -log([H<sup> </sup>]). Brug formlen for vands ionprodukt. Du kender [[H<sub>3</sub>O<sup> </sup>]] og skal så bare isolere [OH<sup>-</sup>]. Svaret er 1,0 x 10<sup>-12</sup>. Du skal først berenge oxoniumkoncentrationen ved at bruge formlen for vands ionprodukt. Du skal finde at [H<sub>3</sub>O<sup> </sup>] er 2 x 10<sup>-14</sup> mol/L. Herefter finder du pH som -log([H<sub>3</sub>O<sup> </sup>]). Regn på stofmængderne. Du har præcis lige meget syre (1 L x 1 mol/L = 1 mol) og base (2 L x 0,5 mol/L = 1 mol) i den endelige opløsning! De reagerer med hinanden og danner salt og vand – altså en neutral opløsning.
#1. Udpeg aller stoffer som giver opløsninger med pH større end 7
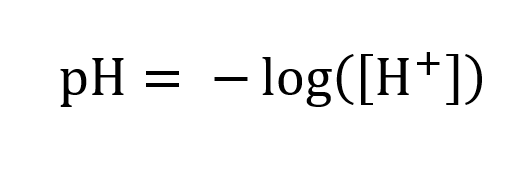
#2. Beregn pH i en saltsyreopløsning med en koncentration på 0,5 mol/L. Angiv dit svar til første decimal.

#3. Beregn [OH-] i en opløsning med en oxoniumkoncentration på 0,01 mol/L. Angiv dit svar som et heltal.

#4. Beregn pH i en opløsning med en koncentration af hydroxid-ioner på 0,5 mol/L.
#5. Du blander 0,5 L HCl-opløsning med en koncentration på 1 mol/L med 2 L NaOH-opløsning med en koncentration på 0,1 L. Hvad bliver pH af den endelige opløsning?
#6. Du blander 0,5 L NaCl-opløsning med en koncentration på 1 mol/L med 2 L NaOH-opløsning med en koncentration på 0,1 L. Hvad bliver pH af den endelige opløsning?
#7. Du blander 1 L HNO3-opløsning med en koncentration på 1 mol/L med 2 L NaOH-opløsning med en koncentration på 0,5 mol/L. Hvad bliver pH af den endelige opløsning?

