Kapitel 1.1
Atomer og det periodiske system
Atomer og stof
Velkommen til første kapitel i kemiguiden.
Du skal indstille dig på at lære ting udenad i dette kapitel – lidt som du skulle lære alfabetet, da du begyndte at læse.
Allerførst skal du vide, hvad atomer er. Alt stof i verden består af atomer. Violiner og stegepander, strømpebukser, brændenælder og flodheste, ja selv luft består af atomer. Du kan tænke på atomer som bittesmå byggeklodser. Grunden til, at der findes forskellige former for stof, skyldes at der er forskellige typer af atomer, og at de kan sættes sammen på forskellige måder.
Hvad er så et atom? Til dette spørgsmål skal du kunne svare, at atomer består af protoner, neutroner og elektroner. Du skal ikke prøve at forstå hvad protoner, neutroner og elektroner er. Faktisk kommer du langt ved at vide tre ting:
1) Protoner har en positiv ladning og elektroner har en negativ ladning, mens neutroner slet ikke har en ladning (vi siger at de er neutrale)
2) Protonerne og neutronerne findes inde i atomets kerne, mens elektronerne befinder sig i skaller uden om kernen
3) I et atom er der altid lige mange protoner og elektroner. Til gengæld kan antallet af neutroner variere.
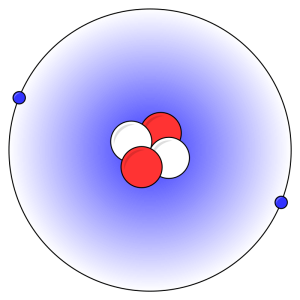
Det er antallet af protoner som afgør, hvilken type atom der er tale om. Hver type af atom kaldes for et grundstof. Det letteste grundstof er hydrogen. Et hydrogen-atom består kun af en enkelt proton og en enkelt elektron. Det næst-letteste grundstof er helium. Figuren oven for viser et helium-atom. Det består af to protoner, to neutroner og to elektroner. I alt findes der 90 forskellige grundstoffer i naturen. Så mange behøver du dog ikke at kende. Langt det meste stof i verden omkring os består af de tyve letteste grundstoffer samt metallet jern (jern har 26 protoner), og i mindre grad metaller som zink (30 protoner), kobber (29 protoner), nikkel (28 protoner) og mangan (25 protoner).
Hvis der kun findes 90 forskellige grundstoffer i naturen, hvordan kan det så være, at der findes mange flere forskellige typer af stof?
Det er fordi atomerne kan sættes sammen på mange forskellige måder. Næsten alt kemi handler om, hvordan man kan skille og forbinde atomer for at lave bestemte stoffer.
Atomets struktur
Du skal vide lidt mere om atomets opbygning. Et atoms struktur har nemlig stor betydning for, hvilke andre atomer det kan binde sig til.
Protonerne og neutronerne er altid inde i kernen som vist på figuren af helium-atomet ovenfor.
Med elektronerne er det anderledes. De befinder sig i forskellige skaller rundt om kernen. Den første skal, det vil sige den, som er tættest på kernen, kan rumme to elektroner. Den næste skal kan rumme 8, og den tredje skal kan rumme 18 elektroner. Disse tal virker tilfældige, men det er de ikke. Man kan regne på, at det er sådan det skal være, men det er meget svært (din lærer har sikkert glemt hvordan) og det er langt ud over pensum i gymnasiet. Du bliver derfor nødt til at huske tallene.
Elektroner vil gerne befinde sig så tæt på kernen som muligt. De bliver nemlig tiltrukket af protonernes positive ladning. Derfor bliver den inderste skal fyldt før de ydre skaller.
Lad os se på grundstoffet oxygen som et eksempel. Et oxygen-atom har otte protoner, otte neutroner og otte elektroner. Hvordan fordeler elektronerne sig i skallerne? Den første skal kan rumme to elektroner, så to af oxygen-atomets elektroner vil befinde sig her. Der er nu seks elektroner tilbage. Den næst-inderste skal har plads til otte elektroner. De seks resterende elektroner vil derfor befinde sig i skal nummer 2. Du kan se oxygenatomets struktur på figuren nedenfor.
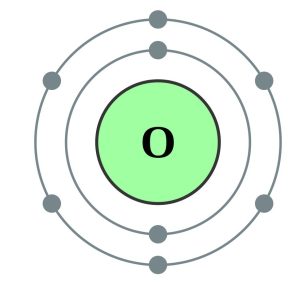
I kemi er vi særligt interesserede i hvor mange elektroner der er i den yderste skal. Den yderste skal er nemlig atomets grænse mod verden uden om. Derfor har elektronerne i den yderste skal særlig betydning for, hvilke andre atomer et bestemt atom kan binde sig til. Det kommer du til at lære mere om i afsnittet om bindinger.
Faktisk er antallet af elektroner i den yderste skal så vigtigt, at alfabetet over grundstoffer – det vi kalder “Det periodiske system” – er indrettet således at man hurtigt kan se, hvor mange elektroner et bestemt grundstof har i yderste skal.
Det periodiske system
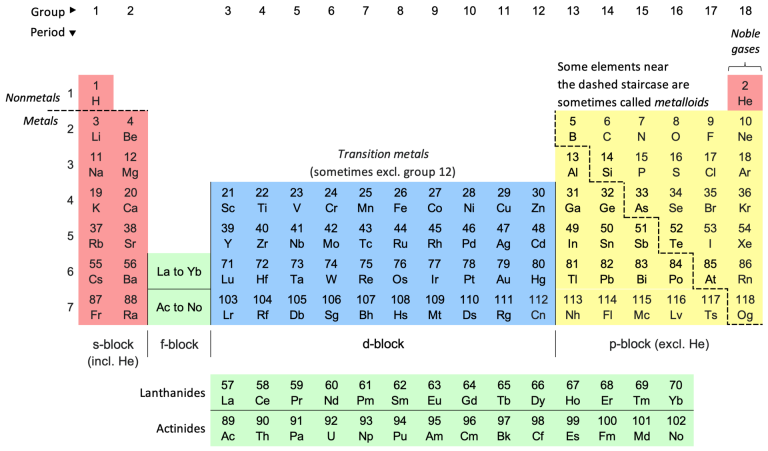
Der er ikke så meget du skal kunne sige om det periodiske system. Til gengæld er det meget vigtigt, at du så kan sige det du skal! Lær dig selv følgende – se grundigt på figuren ovenfor undervejs:
- Det periodiske system er en oversigt over alle kendte grundstoffer. Oversigten er indrettet for at gøre det tydeligt, hvor mange elektroner et bestemt grundstof har i yderste skal
- Nærmere bestemt fortæller perioden, hvilken skal, som har de yderste elektroner. En “periode” svarer til en vandret række i det periodiske system. Således har alle atomer i første række (der er kun hydrogen og helium) deres yderste elektroner i skal nummer 1. For alle atomer i anden række befinder de yderste elektroner sig i skal nummer to – og så videre.
- gruppenummeret fortæller, hvor mange elektroner et grundstof har i yderste skal. Grupperne er de lodrette søjler i det periodiske system. Således har alle grundstoffer i gruppe 1 én elektron i den yderste skal (fx H og Na). Alle grundstoffer i gruppe 2 har to elektroner i yderste skal – og så fremdeles.
- Atomnummeret angiver antallet af protoner i det pågældende atom. Det er alene antallet af protoner, som afgør hvilket grundstof der er tale om.
- Hvert grundstof har en forkortelse. Fx bliver hydrogen forkortet med “H”, natrium bliver forkortet med “Na” og jern bliver forkortet med “Fe”. Disse forkortelser kalder vi for kemiske symboler.
- I nogle udgaver af det periodiske system er der et stort tal ved hvert grundstof. Det store tal er atomets gennemsnitlige masse.
Lad os se på grundstoffet magnesium som et eksempel. Magnesium har det kemiske symbol Mg. Hvad kan vi sige om magnesium ud fra dets plads i det periodiske system? Vi kan sige følgende:
- Magnesium er i gruppe 2 og har derfor to elektroner i sin yderste skal
- Magnesium er i tredje række og har derfor sine yderste elektroner i skal nummer tre
- Magnesium har atomnummer 12 og har derfor tolv protoner
- Et magnesium-atom har den gennemsnitlige masse 24,3.
Du er nu klar til at teste din viden om atomer og det periodiske system. Testen åbner i en ny fane så du hurtigt kan hoppe tilbage hertil for at søge svar.